 留言咨询
留言咨询
 留言咨询
留言咨询
1. Western Blot实验介绍
1.1 实验原理
Western Blot印迹法是把通过电泳分离的蛋白质组分从凝胶转移至一种固相支持物,通过抗体与附着于固相支持物的靶蛋白的抗原表位发生特异性反应进 行检测。Western Blot 既可以定性,又可以半定量,是初步鉴定靶蛋白表达的最方便也是最通用的方法。
1.2 特点
(1)分辨率高,采用 SDS-PAGE 变性电泳;
(2)灵敏度高,可检测到 pg 级;
(3)准确性高,通过与内参蛋白比较对靶蛋白进行相对含量。
2. Western Blot实验步骤
2.1 流程简图:
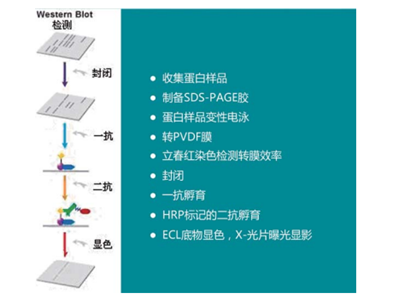
2.2 试剂耗材的准备
2.2.1 SDS-PAGE试剂:
(1)30%储备胶溶液:丙烯酰胺(Acr)29.0g,亚甲双丙烯酰胺(Bis)1.0g,混匀后加ddH2O,37℃溶解,定容至100ml, 棕色瓶存于室温。
(2)1.5M Tris-HCl(pH 8.0):Tris 18.17g加ddH2O溶解, 浓盐酸调pH至8.0,定容至100ml。
(3)1M Tris-HCl(pH 6.8):Tris 12.11 g加ddH2O溶解, 浓盐酸调pH至6.8,定容至100ml。
(4)10% SDS:电泳级SDS 10.0 g加ddH2O 68℃助溶,浓盐酸调至pH 7.2,定容至100ml。
(5)电泳缓冲液(pH 8.3):Tris 3.02 g,甘氨酸 18.8 g,10% SDS 10ml加ddH2O溶解, 定容至1000ml。
(6)10%过硫酸铵(AP): 1gAP加ddH2O至10ml。
(7)2SDS电泳上样缓冲液:1M Tris-HCl (pH 6.8)2.5ml,b-巯基乙醇1.0ml,SDS 0.6 g,甘油 2.0ml,0.1%溴酚兰 1.0ml,ddH2O 3.5ml。
2.2.2 转印相关试剂:
(1)转膜缓冲液(48 mM Tris-HCl,39 mM 甘氨酸,0.037% SDS,20%甲醇):
甘氨酸 2.9 g ,Tris-HCl 5.8 g ,SDS 0.37 g,甲醇200 mL,纯水至1000 mL 溶解后室温保存。
(2)10 × 丽春红染液:
丽春红 S 2.0g, 三氯乙酸 30.0 g, 磺基水杨酸 3.0 g,纯水至100 mL, 使用时将其稀释 10 倍。
(3)TBS 缓冲液:
1 mol/ L Tris-HCl (pH 7.5) 10.0 mL,NaCl 8.8 g, 纯水至1000 mL。
(4)TBST 缓冲液:
含 20%Tween20 的 TBS 缓冲液。
(5)封闭液:
脱脂奶粉(BSA) 5.0 g TBST 100 mL 最好现用现配,用量以盖过膜面即可,一次性使用。
(6)底物显色液 ECL:
4℃避光保存,现用现配。
2.3 蛋白质样品制备(以细胞蛋白样品制备为例)
2.3.1 细胞裂解:
2.3.1.1 悬浮生长细胞:
细胞冰水浴预冷,4℃,200g 离心 10 min,用 1 倍培养基体积的预冷 PBS 离心洗细胞 1 次,加入 1/5 - 1/10 培养基体积的预冷细胞裂解液,根据需要加入 蛋白酶抑制剂。反复吹吸数次,冰上静置 10 min。
2.3.1.2贴壁生长细胞:
培养板 4℃ 预冷,用 1 倍培养基体积的预冷的 PBS 洗细胞 1 次,加 入 1/5 - 1/10 培养基体积的预冷细胞裂解液,根据需要加入蛋白酶抑制剂。用细胞刮 子将细胞刮下来,转移至干净的离心管,反复吹吸数次,冰上静置 10 min。 2 在 4 ℃,14,000 g 离心 10 min。将离心管轻轻转移至冰上,转移上清至干净的离心管, 分装后保存。
2.3.2 蛋白浓度测定:
可选用本实验室微量紫外分光光度计(天根OSE260),也可以采用常用的BCA法测蛋白含量。
2.4 SDS-PAGE 电泳
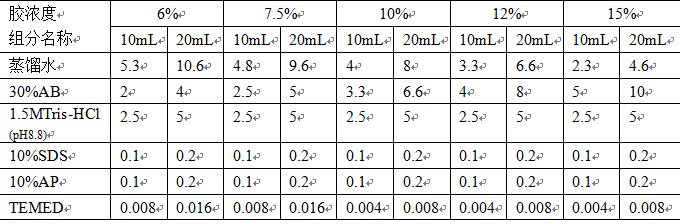
2.4.1 根据蛋白质分子量不同,选择合适的分离胶浓度
按照下表配置分离胶:
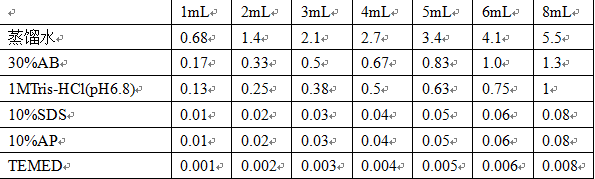
按照下表配置浓缩胶:
2.4.2 具体SDS-PAGE步骤:
1. 清洗玻璃板,晾干。
2. 灌胶:玻璃板对齐后放入夹中卡紧。然后垂直卡在架子上准备灌胶(操作时要使两玻璃对齐,以免漏胶),配置好的分离胶溶液缓慢加入到装配好的板中,上层封水,室温放置0.5-1小时左右至完全凝固; 除去水层,加入浓缩胶溶液,插好梳子。
3. 上样:取提取好的蛋白,加入上样缓冲液,沸水煮沸10min, 约10-15ul加入到上样孔中。
4. 电泳:,电压可选用为 120-160V。电泳至溴酚蓝刚跑出即可终止电泳,然后进行转膜。
2.5 转膜(以湿转为例)(转膜也可以采用中心新近仪器Trans-Blot Turbo 7min完成转膜)
1. 处理好膜和胶。
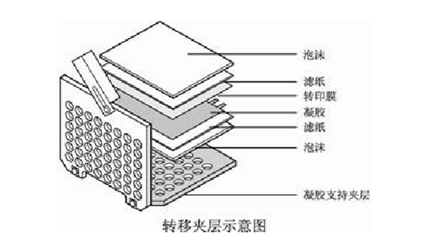
2. 制备三明治结构:将夹子打开使黑的一面保持水平。在上面垫一张海绵垫,擀走气泡,再放滤纸,赶气泡,将处理好的胶放于滤纸上,膜盖于胶上,除气泡,在膜上盖滤纸并除去气泡,最后盖上另一个海绵垫,合起夹子,夹层如下图所示。
3. 将夹子放入转移槽中,要使夹的黑面对槽的黑面,夹的红面对槽的红面。转膜装置置于冰水中,100V,1h转膜。
4. 转完后可以将膜用1×春红染液染5min,判断转膜效果。
2.6 免疫反应 (免疫反应过程可使用中心新近仪器Blot Cycler 完成)
(1)封闭:封闭液孵育膜1-2h。
(2)一抗:一抗稀释液孵育膜约2-3h,用TBST(现配)在室温下脱色摇床上洗3次,每次5-10min。
(3)二抗:准备二抗稀释液并与膜接触,室温孵育 2h 后,用TBST在室温下脱色摇床上洗3次,每次5-10min。
2.6 ECL化学发光检测
1. 将 A 和 B 两种试剂在离心管中等体积混合,1min 后,将溶液平铺在膜上
2. 成像仪成像,并进行图像分析